嘉源研究

嘉源研究 | 医疗器械公司如何带已注册产品进军港股18A
2021-12-01 2192作者:陈婕、张超
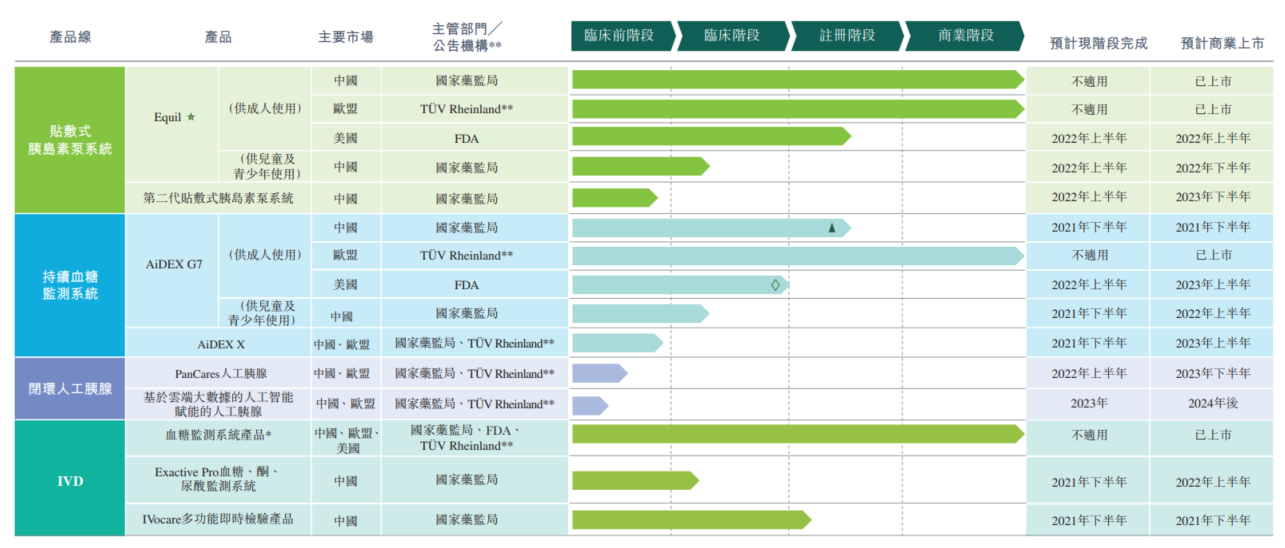
导言 自港交所2018年修改《上市规则》引入18A章,允许生物科技公司于香港上市后,截止至2021年11月19日,共有45家未盈利生物科技公司根据《上市规则》第18A章在香港交易所主板上市。在众多上市公司中,我们注意到近期一些医疗器械公司,其部分核心产品已完成注册,甚至已开始商业化途径,例如微泰医疗,先瑞达等,其均根据联交所18A规则于H股成功上市,打破了大家对“未盈利”的固有印象。那么对于这些已有收入的医疗器械公司,是如何适用联交所18A规则于H股上市的呢,本篇文章将通过研究部分医疗器械公司上市案例总结其基于18A规则的H股上市方案,希望带给市场上同类情况的其他医疗器械企业一些上市启发。为本文之目的,已有收入的医疗器械公司指已有核心产品完成注册上市及商业化但仍无收入或无法达到上市规则第8.05(1)-第8.05(3)条相关测试的医疗器械公司。 一、18A规则上市要求及生物科技公司的上市身份认定 首先根据《香港联交所主板上市规则》(以下简称“《上市规则》”)第18A章规定,如若申请人为未能通过《上市规则》第8.05(1)条的盈利测试、第8.05(2)条的市值、收益或现金流量测试或第 8.05(3)条的市值或收益测试的生物科技公司,可在符合第18A章的要求下寻求上市,其具体的上市要求如下所示: 1 符合资格 证明其合资格及适合以生物科技公司的身份上市 2 上市市值 上市时的市值至少达15亿港币 3 管理团队稳定 上市前已由大致相同的管理层经营现有的业务至少两个会计年度 4 营运资金 确保申请人有充足的营运资金(包括计入新申请人首次上市的所得款项),足可应付集团由上市文件刊发日期起至少十二个月所需开支的至少125%。该等开支应主要包括一般、行政及营运开支(包括任何生产成本)及研发开支。 对于预意在联交所上市的已有收入的医疗器械公司,最为关注的重点即为如何判断是否合资格及适合以生物科技公司的身份上市。根据联交所出具的《指引信HKEX-GL92-18》(简称“指引信”),以合资格及适合以生物科技公司的身份上市必须符合以下条件: 符合对生物科技公司的定义 \ 至少有一项核心产品已通过概念阶段 医疗器械类产品: (i)为二级或以上分类医疗器材; 主要专注于研发以开发核心产品 \ 上市前最少十二个月已从事核心产品的研发 部分示例:若核心产品已经在特定市场上推出并用作特定适应症,而生物科技公司有意将上市所得款项部分用于以下方面: 上市集资主要作研发用途,以将核心产品推出市场 \ 其他条件,如: (1)拥有与其核心产品有关的已注册专利、专利申请及/或知识产权;(2)建议上市日期的至少六个月前已获至少一名资深投资者提供相当数额的第三方投资且至进行首次公开招股时仍未撤回投资。 \ 二、已有收入的医疗器械企业上市的产品计划 首先我们对近期已有收入的医疗器械公司的产品上市计划和募集资金使用进行总结分析: 1、先瑞达 先瑞达医疗科技控股有限公司(简称“先瑞达”)是一家创新医疗器械企业,研发多种治疗血管疾病的介入医疗器械,其上市认定的核心产品为AcoArt Orchid & DhaliaTM以及AcoArt Tulip & Litos,两种核心产品均已完成在中国和欧盟的注册及部分商业化。可见先瑞达已无法从推动产品研发及注册的角度说明其上市目的,那么为符合18A上市要求,先瑞达采用了《指引信》的示例即“扩大适应症人群”和“扩展新市场”两步走方式来论述其上市目的。例如计划扩大两款核心产品的适应症,将AcoArt Orchid & Dhalia的适应症拓展至治疗AVF狭窄、VAO狭窄以及血管源性ED,并拓展于巴西、欧盟、亚洲等其他新市场并完成产品注册;同时将AcoArt Tulip & Litos的适应症拓宽于治疗血管源性ED,并于美国、巴西、印度等欧盟、亚洲及南美新市场推出、进行临床试验或产品注册。 (核心产品管线图) 同样的,先瑞达将募集资金相应用于产品“扩大适应症”和“扩展新市场”的方向,具体如下表所示: 募集资金使用对象 该对象的募集资金使用比例 募集资金使用对象的具体用途 该具体用途的募集资金使用比例 核心产品 32% 将AcoArt Orchid & Dhalia的适应症拓展至治疗AVF狭窄 1% 将AcoArt Orchid & Dhalia的适应症拓展至治疗VAO狭窄 2% 将AcoArt Orchid & Dhalia的适应症拓展至治疗血管源性ED 2% 将AcoArt Orchid & Dhalia拓宽于海外市场 2 将AcoArt Tulip & Litos拓宽于海外市场 6% 将AcoArt Tulip & Litos的适应症拓展至治疗血管源性ED 3% 用于AcoArt Orchid & Dhalia及AcoArt Tulip & Litos在中国及海外进行的持续销售及营销活动 16% 先瑞达目前已成功在联交所上市,可见该核心产品上市方案已被联交所认定符合“上市前最少十二个月已从事核心产品的研发”之要求。 2、微泰医疗 与先瑞达类似,微泰医疗器械(杭州)股份有限公司(简称“微泰”)的核心产品也完成了注册及商业化。根据微泰的招股说明书,微泰于上市之日前已完成贴敷式胰岛素泵系统产品及持续血糖监测系统产品在中国及欧盟的注册及商业化,其中Equil贴敷式胰島素泵系统为本次上市定位的核心产品。为符合18A上市要求,微泰同样采取了“扩大适应症”和“扩展新市场”两步走的方式。具体而言,微泰计划扩宽Equil的使用范围至儿童及青少年方面,并预计2022年上半年在中国完成注册临床试验及向国家药监局提交注册申请;同时计划完成AiDEX G7于中国的注册及商业化,并基于已完成的持续血糖监测系统,将其使用人群拓宽至无需强化治疗的糖尿病患者、糖尿病前期人群及注重健康的非糖尿病用户,开发AiDEX X产品。截止招股说明书签署之日,微泰已完成了AiDEX X的可行性分析。公司计划分别于2022年下半年就AiDEX X完成相关注册临床试验并向国家药监局提交相关注册申请。 (微泰产品管线图) 微泰也同步计划将募集资金应用于“扩大适应症人群”和“扩展新市场”的方向,具体如下表所示: 募集资金使用对象 该对象的募集资金使用比例 募集资金使用对象的具体用途 该具体用途的募集资金使用比例 核心产品Equil 31% Equil的适用范围扩展至儿童及青少年糖尿病患者,并完成临床试验及中国国家药监局的注册 14% 增强Equil的商业化能力 11% 升级目前Equil的生产线 6% 持续血糖检测系统产品 35% 用于第二代持续血糖检测系统产品AiDEX X的临床前研究 10% 用于扩大AiDEX G7的适用人群于儿童及青少年的临床试验 12% 用于升级目前AiDEX G7的生产能力 6% 用于增强AiDEX G7的商业化能力 7% 因此,微泰的上市计划和募集资金的使用途径上也是围绕“扩大适应症”和“扩展新市场”两方面展开,以使其符合18A规则下对申请人产品的相关要求。但值得注意的是,扩大适应症不仅仅为扩大产品针对的适应症种类,微泰扩大适应症人群的方式也被联交所认可为一种扩大方式。当然,我们认为在微泰通过18A的要求是因为其将扩大适应症人群和扩大新市场综合进行,对于仅扩大适应症人群是否能符合18A要求,仍需进一步向联交所做产品适格性咨询。 3、心玮医疗 上海心玮医疗科技股份有限公司(简称“心玮”)的情况与微泰、先瑞达相似,其核心产品为Captor取栓器械及左心封堵器,其中Captor已完成了在中国的注册及商业化,左心耳封堵器正在NMPA注册审查中。根据心玮的招股说明书,为符合18A上市要求,心玮同样采用了“扩大适应症”和“扩大新市场”两步走的方式,例如将扩大Captor的适应症范围,包括对出现症状8-16小时的缺血性脑卒患者进行脑血栓清除,并推动Captor取得FDA注册及CE标识。 在心玮的募集资金的使用计划中,用于扩大Captor的适应症及市场的比例为约10.9%,23.4%用于促进Captor的生产及商业化,11%的募集资金用于另一核心产品左心耳封堵器的研发及商业化,另有39.9%用于其他在研产品。心玮一方面扩大其已注册产品的适应症及新市场,一方面推动其他在研产品的注册及商业化的上市计划也同样获得了联交所的认可。 因此,根据18A的上市条件及指引信中列出合资格及适合以生物科技公司的身份上市条件,一般情况下,对于申请人的核心产品已过概念阶段但仍未上市的情况,其产品的上市计划即为推动核心产品完成注册及商业化。但对于已有收入的医疗器械公司,最重要的是判断“上市前最少十二个月已从事核心产品的研发”对医疗器械行业上市申请人的要求。以上案例可见医疗器械公司的上市计划均基于指引信的示例来进行进一步的分析和制定,将上市所得款项部分用于核心产品的:(1)扩大该已推出市场的生物科技产品的适应症,或(2)在其他市场上推出有关产品,以获得联交所对其产品上市目的的认可。 三、总结 根据以上案例,已有收入的医疗器械企业预意进军香港市场,基本上采用扩大已注册产品的适应症及新市场的方式,同时兼顾已注册产品的商业化和其他在研产品的上市研究。同时根据我们的项目经验,当申请人制定扩大适应症计划时,还需关注合理安排时间表,预测新适应症的临床试验周期,使得申请人上市前对新适应症至少已进行了一次人体临床试验。另外,建议申请人根据A1时间点预计新适应症的进展情况,同时兼顾时间表和募集资金使用的要求。 最后我们建议,为确保已有收入的医疗器械行业申请人能够符合18A的上市要求,申请人及相关中介可于上市前向联交所进行充分的产品适格性咨询,确保其未来推出上市产品并募集资金的使用能够通过联交所的认定。 作者简介 陈婕 高级合伙人 张超
(ii)已至少通过一次人体临床试验;及
(iii)主管当局或认可机构同意或并无反对申请人开展进一步临床试验或开始销售有关器材
(1)扩大该已推出市场的生物科技产品的适应症,或;(2)在其他市场上推出有关产品。